| |
Hélium : du cri du canard au superfluide |
| |
 |
Par Franck Stevens
Article mis en ligne le 14/04/13 |
C'est l'ingrédient incontournable des ballons de foire et de lâimitation de palmipèdes : je veux bien sûr parler de lâhélium. Un gaz aux caractéristiques étonnantes qui va peut-être bientôt venir à nous manquerâ¦
Ce nâest pas sa propriété la plus étrange, mais câest sans doute la plus célèbre : respirer de l'hélium donne une voix de canard. Ce gaz étant plus léger que lâair, les sons sây propagent en effet plus rapidement, ce qui augmente leur fréquence â en d'autres termes, cela les rend plus aigus. De la même façon, remplir vos poumons avec un gaz beaucoup plus lourd que l'air (typiquement, de l'hexafluorure de soufre {$ SF_6$) peut vous donner un timbre plus grave. Lâidéal si vous souhaitez chanter du Barry White ou annoncer à votre fils perdu que vous êtes son père !
Adam Savage de Mythbusters inhale de l'hélium puis de l'hexafluorure de soufre
Vidéo : Mythbusters, Discovery Channel
Ãvitez toutefois d'inhaler n'importe quelle substance pour en mesurer l'effet sur votre voix : même s'il peut (comme tout autre gaz) provoquer la mort par asphyxie si on le respire trop longtemps en lieu et place d'oxygène, l'hélium présente lâavantage non négligeable de ne pas être toxique. Il est en effet considéré comme « inerte », câest-à -dire très peu susceptible de participer à des réactions chimiques, caractéristique qu'il partage avec la plupart des autres éléments chimiques de sa famille, les « gaz nobles », ou « gaz rares ».
Ce nom de « gaz rare » peut toutefois paraître ironique dans le cas de l'hélium puisquâil sâagit du second élément le plus abondant dans lâunivers (environ 24% de la masse de lâunivers visible), juste après lâhydrogène (74%) ! Ces deux éléments sont en effet les plus simples qui puissent exister, ce qui leur a permis de se former spontanément à partir de la soupe bouillante de neutrons, de protons et dâélectrons qui composait lâunivers quelques minutes après le Big Bang. La plupart des autres éléments chimiques ont quant à eux été formés au cours des milliards d'années qui ont suivi par des réactions de fusion nucléaires qui ont lieu au cÅur des étoiles, qui sont elles-mêmes majoritairement composées d'hydrogène et d'hélium.
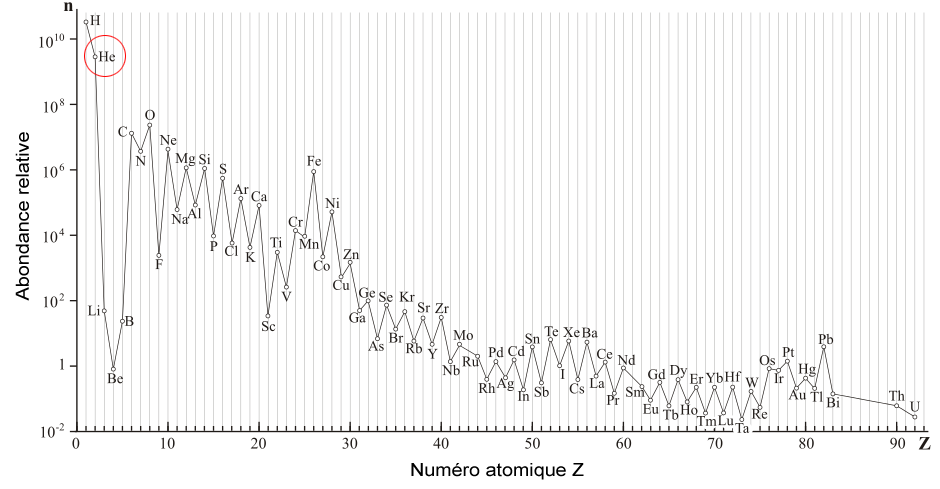
Abondance relative des éléments chimiques en fonction de leur numéro atomique
Images : Wikimedia Commons

Abondance relative des éléments chimiques en fonction de leur numéro atomique
Images : Wikimedia Commons
C'est d'ailleurs alors quâil étudiait notre étoile que le Français Jules Janssen a découvert l'hélium en 1868, d'où son nom inspiré d'Hélios, dieu solaire de la mythologie grecque. Il a toutefois fallu attendre plus de quinze ans pour que lâon sâaperçoive que l'hélium existait également sur Terre, ou plus exactement sous terre : on le trouve notamment mélangé au « gaz naturel » (du méthane) dans dâénormes poches souterraines. Lâhélium nâest par contre présent quâen très petite proportion dans notre atmosphère : à conditions égales, il est environ sept fois plus léger que l'air, si bien qu'il a naturellement tendance à s'élever, à s'élever et... à sâéchapper dans l'espace !
Or, le seul processus naturel terrestre qui génère de lâhélium est la désintégration spontanée de certains éléments radioactifs, qui nâen produit quâune quantité modeste. Les ressources en hélium de notre petite planète sont donc limitées, ce qui pousse de plus en plus de scientifiques à tirer la sonnette dâalarme : vu la vitesse à laquelle nous consommons lâhélium actuellement, il nâen restera plus dans trente ans !
Au-delà de son utilisation dans les ballons de foire et les dirigeables, lâhélium a pourtant des applications variées. Il joue par exemple un rôle crucial dans le domaine de la cryogénie (et plus particulièrement dans le refroidissement des aimants utilisés en IRM), mais aussi dans de nombreux domaines industriels qui impliquent des éléments sensibles ne pouvant être exposés à lâair ou encore en plongée, où on lâutilise comme substituant partiel de l'azote dans les bonbonnes dâair pour limiter les effets de l'ivresse des profondeurs.

Quelques-unes des nombreuses applications de l'hélium
Images : Wikimedia Commons

Quelques-unes des nombreuses applications de l'hélium
Images : Wikimedia Commons
Ces utilisations de lâhélium sont motivées par ses caractéristiques privilégiées puisquâen plus dâêtre léger et inerte, il conduit particulièrement bien la chaleur et reste sous forme gazeuse même à basse température. Sa propriété la plus épatante est toutefois à mon humble avis celle qui se manifeste lorsquâon le porte à très basse température, à deux degrés à peine au-dessus du zéro absolu (soit â271°C), car il se métamorphose alors soudain en un « superfluide ». Ne comprenez pas par là quâil enfile soudain un costume en latex et une cape, mais plutôt quâil se transforme en un liquide dépourvu de viscosité : il devient alors non seulement capable de sâécouler plus efficacement que nâimporte quel liquide, mais aussi de défier la gravité pour « grimper » le long des parois du récipient qui le contient pour sâen échapper !
Que ce soit en quittant lâatmosphère sous sa forme gazeuse ou en escaladant les murs de son prison sous forme de superfluide, lâhélium a donc une tendance naturelle à vouloir jouer les filles de lâair. Nâhésitez pas à partager ce fait étonnant de votre voix la plus nasillarde la prochaine fois que vous inhalerez de lâhélium pour épater vos amis, mais gardez en tête que ce faisant, vous gaspillez un gaz qui vaudra sans doute bientôt son poids (certes modeste) en orâ¦
Propriétés étranges de l'hélium superfluide
Vidéo : BBC
Copyright et licence |
- Les images et vidéos utilisées sur cette page sont la propriété de leurs auteurs respectifs
- Le texte est quant à lui la propriété intellectuelle de Franck Stevens
- Vous avez le droit de reproduire ce texte à des fins non commerciales et de le modifier, à condition d'indiquer clairement vos modifications, de mentionner explicitement le nom de l'auteur et d'inclure un lien en dur vers cette page, selon les termes de la Licence Creative Commons Attribution - Pas dâUtilisation Commerciale - Partage dans les Mêmes Conditions 3.0 non transposé.

Classement |
 Auteur(s) : Franck Stevens
Auteur(s) : Franck Stevens
 Catégorie : Article
Catégorie : Article
 Discipline(s) : Chimie, Physique
Discipline(s) : Chimie, Physique
Voir les pages... |











